Nature子刊:叶克强团队在阿尔茨海默症发病机制研究领域获得新进展
本文转自:中国生物技术网
3月25日 , Nature Structural & Molecular Biology杂志在线发表了中国科学院深圳理工大学(暂定名 , 以下简称“深理工”)叶克强团队和武汉大学人民医院张振涛团队的最新成果 。研究团队发现脑内蓝斑部位的去甲肾上腺素代谢产物DOPEGAL共价修饰Tau蛋白的K353位点 , 促进Tau的聚集和病变的播散 。本研究为探索阿尔茨海默病(Alzheimer’s disease, AD)的发病机制提供了新的视角 。
【Nature子刊:叶克强团队在阿尔茨海默症发病机制研究领域获得新进展】论文上线截图
(点击文末“阅读原文”可查看论文)
AD是临床上最常见的神经退行性疾病 , 脑内Tau蛋白的异常聚集是AD重要的病理表现 。但迄今为止 , Tau蛋白异常聚集的分子机制尚不明确 。病理学研究发现蓝斑是脑内Tau蛋白聚集的起始位点之一 , Tau蛋白首先在蓝斑形成病理性聚集体 , 并向其它脑区播散 , 导致脑内广泛的Tau蛋白聚集和神经损伤 , 最终导致认知功能障碍的发生 。那么 , 为何蓝斑部位的Tau蛋白更容易聚集呢?
研究团队针对脑内Tau蛋白聚集的分子机制进行了长期的探索 。团队前期研究发现蓝斑部位的单胺氧化酶A(MAO-A)将去甲肾上腺素氧化为DOPAGEL , DOPAGEL激活了天冬酰胺内肽酶(AEP)的表达 , AEP剪切Tau蛋白 , 促进其聚集和播散(Journal of Clinical Investigation, 2020) 。
文章图片
文章图片
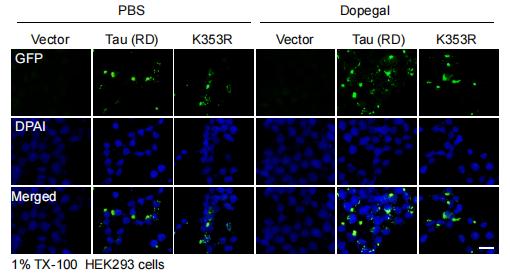
DOPAGEL促进细胞内Tau的聚集
而K353R突变可以阻断DOPEGAL的促进作用
接下来 , 该团队发现ApoE3与Tau相结合 , 减少AEP对Tau的剪切 , 但AD相关的等位基因ApoE4失去了结合Tau蛋白的能力 , 使Tau更容易被AEP剪切 。另一方面 , ApoE4能够抑制囊泡单胺转运蛋白VMAT的水平 , 使去甲肾上腺素难以进入突触囊泡 , 而滞留在胞浆中被MAO-A氧化 , 生成DOPAGEL(Acta Neuropathologica, 2021) 。
在最新发表的研究中 , 该团队进一步深入研究了DOPAGEL对Tau的修饰作用 , 发现DOPAGEL可以直接共价修饰Tau的K353位点 , 与全长的Tau相比 , AEP剪切形成的Tau蛋白片段更容易被DOPAGEL修饰 。DOPAGEL修饰的Tau蛋白聚集能力更强 , 而且形成的病理性聚集体作为“种子”诱导Tau蛋白单体的聚集能力更强 。在Tau转基因小鼠脑内阻断MAO-A的活性 , 或者将Tau的K353位点突变后可以阻断DOPAGEL对Tau的修饰 , 部分缓解Tau病变的播散 。
文章图片
文章图片
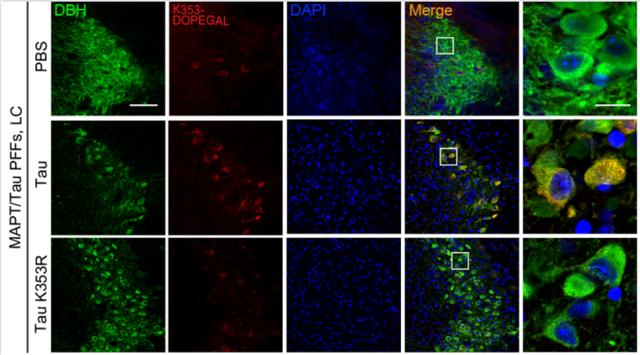
阻断DOPEGAL对Tau的修饰可以延缓Tau的聚集 ,
向过表达Tau的转基因小鼠脑内注射Tau聚集体可以诱导脑内的Tau聚集 , 而突变K3533位点后阻断了DOPEGAL对Tau的修饰 , 脑内Tau的聚集减少 。
本研究的意义在于揭示了AD发病过程中 , 为何蓝斑区域的Tau蛋白首先发生聚集形成病理性包涵体 , 对理解AD患者脑内Tau蛋白聚集体的起始和播散过程具有非常重要的启示作用 。这样在AD疾病的早期对MAO-A用小分子药物进行抑制可能极大减缓Tau的病理改变 。但是 , 这一新机制的发现是否也可以推广到其他与Tau病理改变有关的Tauopathies疾病还需要进一步实验验证 。
叶克强教授是深理工生命健康学院生物学系主任 , 曾任美国埃默里大学终身教授 。他是世界公认的神经退行性疾病领域国际权威 , 尤其在小分子化合物靶向药物治疗神经退行性疾病方向取得了突破性进展 , 他所发现的多个药物现已经或即将进入临床试验 。叶教授目前正带领团队进行与衰老相关疾病新药物的开发研究 。此次发布的科研成果 , 也是其在阿尔兹海默症病机制研究领域取得的又一重要进展 。
推荐阅读
- 预防骨质疏松,光补钙还不够!《柳叶刀》子刊全面总结饮食影响,快收藏
- 只要多睡觉,2周瘦1斤!JAMA子刊临床试验证明:充足睡眠可减少热量摄入
- 呼吸道合胞病毒 Nature重磅 确定呼吸道合胞病毒感染人体的第一步
- 时尚芭莎电子刊 初代主编渐次退场 写鸡汤文、卖电子刊的时尚杂志还时尚吗
- Nature:AI看看你的眼睛,就能预判心脏病
- 慢性腰痛怎么办?JAMA子刊新研究发现,水上运动效果倍儿棒
- 小时候糖吃多了,长大后记性会变差| Nature子刊最新研究
- 天然衰老清除剂被发现?《nature》子刊最新研究:PCC1可延寿64.2%
- Nature:我国学者首次揭示糖蛋白激素作用机制
- 重大突破!暨大研究团队发现减肥新途径,登上《Nature》正刊






