肿瘤精准治疗的挑战与未来( 三 )
文章图片
文章图片
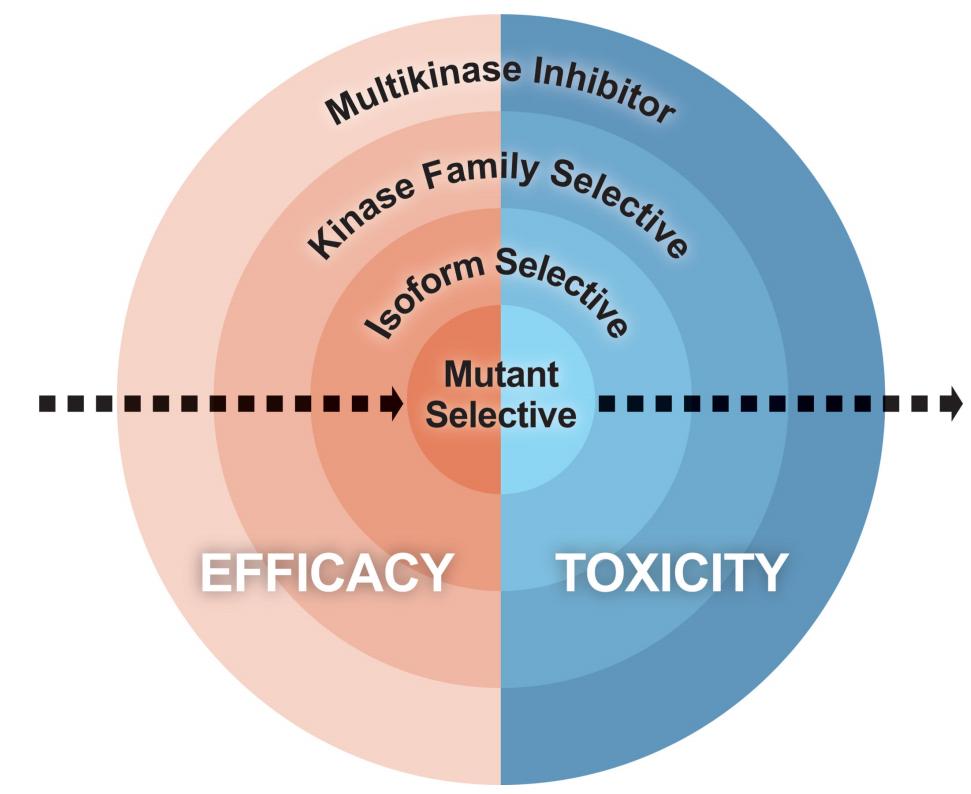
例如 , 在约2%的肺腺癌和高达20%的甲状腺乳头状癌中发现活化RET改变 , 而多重激酶抑制剂( MKI )会有一定程度的RET抑制 , 如lenvatinib、vandetanib、cabozatinib和ponatinib , 在RET突变的肿瘤中表现出有限的临床活性 。然而 , 所有这些药物都表现出更强的非靶向抑制作用 , 典型的是VEGFR( KDR ) , 这决定了它们的剂量限制毒性 , 从而无法达到最大的RET阻断 。相反 , 选择性RET抑制剂 , 包括selpercatinib( LOXO-292 )和pralsetinib( BLU-667 ) , 已经被开发出来 , 允许有效和持续的靶向抑制 , 与MKIs相比 , 已证明具有显著的疗效和良好的安全性 。所以 , 对单个癌症的基因组驱动因素的进一步了解 , 加上结构生物学的进展 , 使得能够开发出合理的、适合于特定目的的药物 , 这种选择性抑制剂的产生对于优化耐受性和最大化治疗效果至关重要 。
耐药性在设计药物时 , 应考虑原发性和获得性耐药的潜在机制 。考虑因素包括由药物渗透性引起的耐药性以及继发于分子改变的耐药性 。对于脑转移常见的癌症 , 包括NSCLC、乳腺癌和黑色素瘤 , 确保针对这些癌症关键基因组改变的药物具有足够的中枢神经系统( CNS )渗透性已成为一个关键设计参数 。虽然第一代ALK抑制剂crizotinib可实现高初始全身疾病控制率 , 但脑部渗透性差导致多达60%的患者在接受治疗时出现CNS进展 。对新一代ALK抑制剂的前瞻性评估表明 , 大脑内的疾病控制显著改善 , 最终有助于提高无进展生存率和总生存率 。

文章图片
文章图片
除了由药物渗透性决定的耐药性外 , 药物开发越来越多地考虑到靶向获得性耐药性的预测机制 。例如 , 连续几代的ALK抑制剂被专门设计针对突变来维持结合效力 。药物开发的新领域
异构体和突变选择性抑制剂认识到更多的选择性治疗往往具有更好的疗效和耐受性 , 一些策略被用来更具体和直接地抑制致癌驱动因素 , 包括开发异构体和突变选择性抑制剂 。

文章图片
文章图片
例如 , PI3K途径是癌症中最常见的突变途径之一 , 但早期用pan-PI3K抑制剂仅显示出有限的疗效 。相比之下 , 亚型选择性PI3K抑制剂相对于pan-PI3K和双PI3K/mTOR抑制剂显示出更好的疗效 。此外 , 异构体特异性抑制剂可将归因于“脱靶”异构体的毒性降至最低 。近年来 , 药物的选择性已经超越了异构体的选择性 , 向单个突变等位基因发展 。这种选择性允许抑制突变的致癌蛋白 , 同时保留野生型蛋白 。KRAS是癌症中最常见的突变癌基因之一 , 但尽管它被认为是一个关键的致癌驱动因素 , 但一直以来它被认为是不可成药的 , 部分原因是缺乏可靶向的结合位点 。然而 , 最新的设计允许与KRAS G12C的突变半胱氨酸发生反应 , 形成不可逆的结合并将蛋白质锁定在其非活性结合状态 。在缺乏这种突变半胱氨酸的情况下 , 这些共价抑制剂不会与野生型KRAS发生反应 , 从而保护正常组织 。KRAS G12C抑制剂I期试验的早期结果证明了这种靶向突变的有效性和安全性 。
抗体偶联药物(ADC)另一种提高治疗指数的方法是使用抗体偶联药物 。通过将细胞毒性有效载荷直接连接到靶向抗体 , ADC被设计为可扩展传统细胞毒性药物的治疗窗口 。
推荐阅读
- 熬夜导致睡眠紊乱 去年6万余人找医生治疗失眠
- 青春不留痘!本周末,云大医院专家团齐聚痤疮治疗名医工作站会诊!
- 四川华美紫馨皮肤科院长李纯青受邀参会,解读《微针治疗操作规范》
- 「公益征集」银屑病(牛皮癣)患者100名,在线申请精准检查援助
- 货车司机突发罕见感染重症深圳平乐医院中西医协同治疗成功救治
- 日企粒子线癌症治疗系统:癌细胞杀伤力倍增
- 5天完成门诊血液透析室扩容 交大一附院承担高新区部分透析病人治疗
- 精准诊断,济医附院开展两例心脏活检术
- 新冠概念股远大医药治疗重症新冠临床研究获重要进展
- 延缓衰老、改善生长发育、抑制肿瘤......7项保健食品功能拟取消













